在创新药的投资中比较重要的事,一方面是对于个体alpha的甄别,但另一方面一些大的技术趋势如果不抓住就很难获得比较高的投资收益。比如说这两年如果没有在ADC和双抗两个方向进行较大的投入,那么在市场涨涨跌跌的波动中,抓住投资收益还是比较难的。
参考以前的文章:
《创新药系列之三:关于ADC、双抗和CAR-T》复盘(原文写于2024年1月)
从2023年开始看创新药,就大的技术方向而言,当时最重视的是上述三个技术平台。最近打算做一些自上而下的研究,快速回顾一下看看在技术方向上有没有一些新的变化。本篇文章是可能会进行的系列快速研究之一。
正如之前复盘时提到当时最重视的三个技术方向,有两个方向事后都得到了充分的验证,但是CAR-T这个方向目前看发展速度不及预期。从技术角度而言,在单抗大时代之后,ADC和双抗的确是两个相对低垂的果实。而CAR-T这个方向需要突破的技术难点稍多。虽然有几个产品也陆续上市,但是由于一些客观原因,行业难以获得丰厚的收入和利润。因此这两年对于如何将CAR-T技术路线发扬光大变成了业界思考的难题之一,如实体瘤CAR-T怎么做、异体CAR-T怎么规模化、以及本文的in-vivo CAR-T都是相对比较热门的方向。比较而言,本文的方向相对比较新,短期也难以看到太多的落地。今年年末听了小宇宙上万物生长这个播客,听到他们评选的年度十大生物医药科技创新方向,我个人将in-vivo CAR-T列为其中最有吸引力的新方向。今天正好借着翻阅和总结这篇研报的机会,进行一个简单的概况。
首先既然同样是注射到体内,在定义上大概区分一下in-vivo CAR-T技术方向(特别是LNP递送这个子方向)和之前就已经比较火热的小核酸药的区别(小核酸药也是个值得关注的新兴方向、另文研究)。
两者的共性:都是在瞄准此前抗体药物的理论不可成药靶点。众所周知,只有百分之十几的人体蛋白质是存在于细胞膜表面、可以被潜在的抗体药物所靶向的,实际成药的则只有几百个。大量的其他蛋白质有比较明确的致病机制已经被认识到,但是由于抗体药物是大型蛋白质无法穿透细胞膜,因此这些潜在靶点难以用常规的抗体药物思路进行药物构建。in-vivo CAR-T(LNP递送)技术方向和小核酸药物都是把核酸分子递送到细胞体内,然后去实现相应的治疗机制。
两者的区别:两者的机制差异简而言之,一个是靶向基因,一个是靶向细胞,虽然对传统的靶向蛋白的思路都是一个升级。小核酸药通过把RNA递送到细胞内部去,影响原来的基因表达、生成蛋白质的过程,因此只需要传递十几到几十个nt的短链,至于递送细胞目标,可以是肝细胞为主的各种细胞。而后者则必须准确靶向到T细胞,完成对T细胞直接改造,使得细胞表达出全新的CAR蛋白质,从而实现新的细胞功能,因此需要递送长达数千nt的核酸链。
好,最后总结一下这篇研报的极度脱水版总结。感兴趣的还是建议查一下原文去阅读。请注意,我只有阅读、并没有转载这篇研报的权限。我仅将研报的主要内容先总结在这里,后面又摘抄了几张其中我觉得最有价值的PPT,当然如果作者认为有侵权,可以随时联系我删除。
研报总结:
In Vivo CART 的核心目标
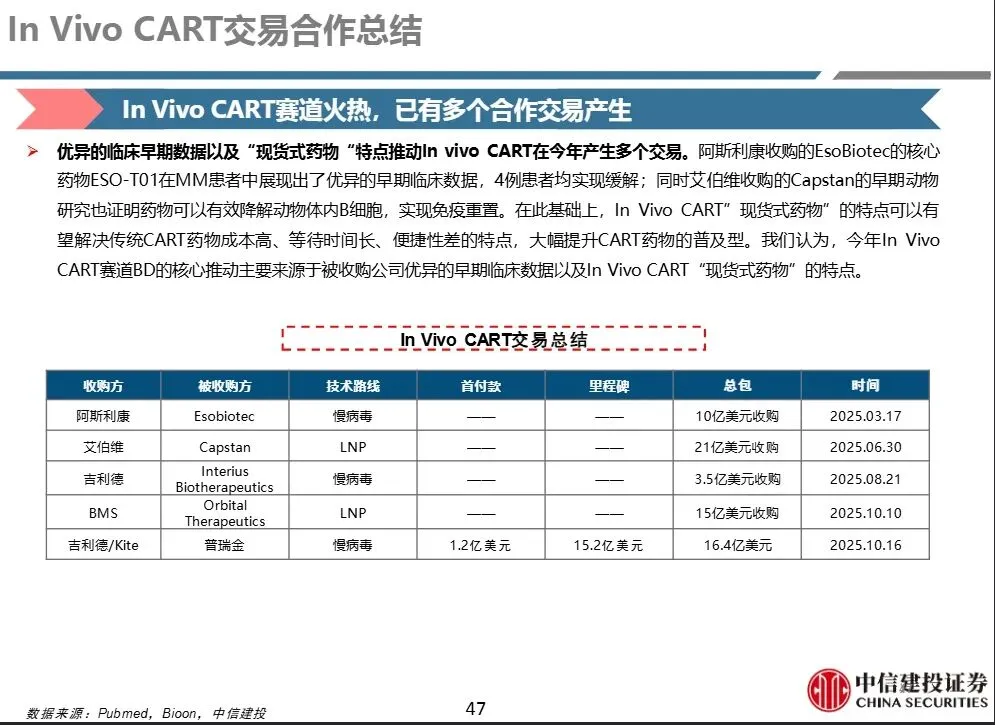
- 通过体内直接改造T细胞生成CAR-T,实现“现货型”药物,解决传统CAR-T“一对一”定制、成本高、等待时间长、需要清淋等问题。
现有CAR-T的局限性
- 需从患者体内提取T细胞 → 体外培养 → 回输,流程耗时4–8周。
- 成本极高:美国上市产品定价30万–56万美元/次,中国超100万元;主要因人工操作和个体化生产。
- 治疗延迟影响疗效:研究显示V2V时间越短,患者生存期越长(如LBCl患者V2V从54天缩短至24天,中位生存期提升1年)。
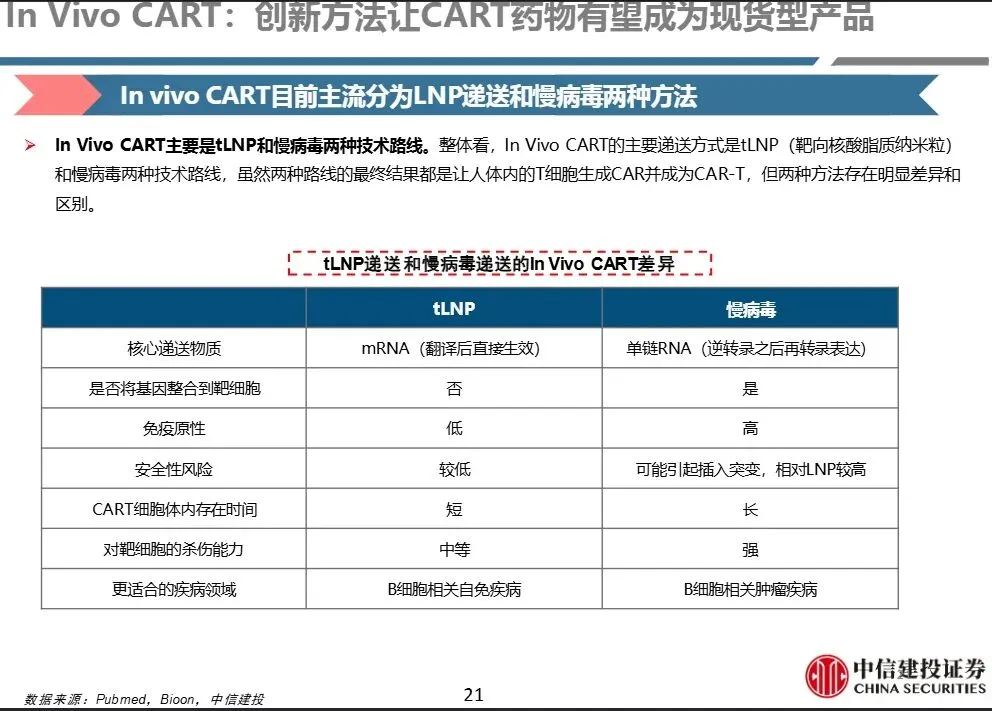
In Vivo CART 技术路线分类主要分为两类:
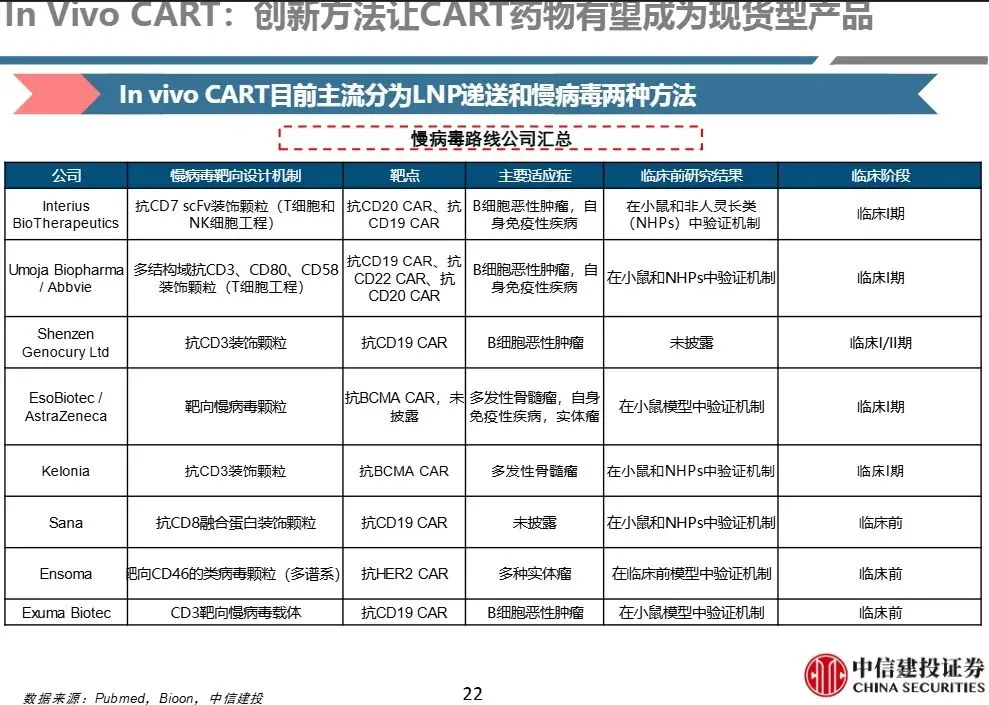
- 1、慢病毒载体路线
- 核心物质:单链RNA(逆转录后整合入基因组)
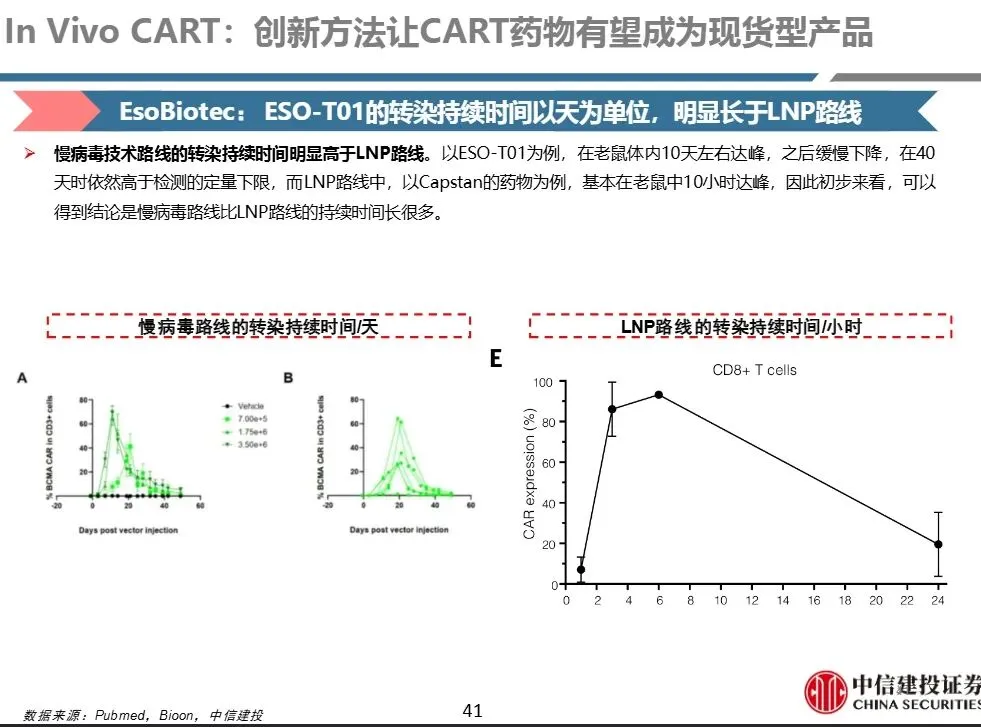
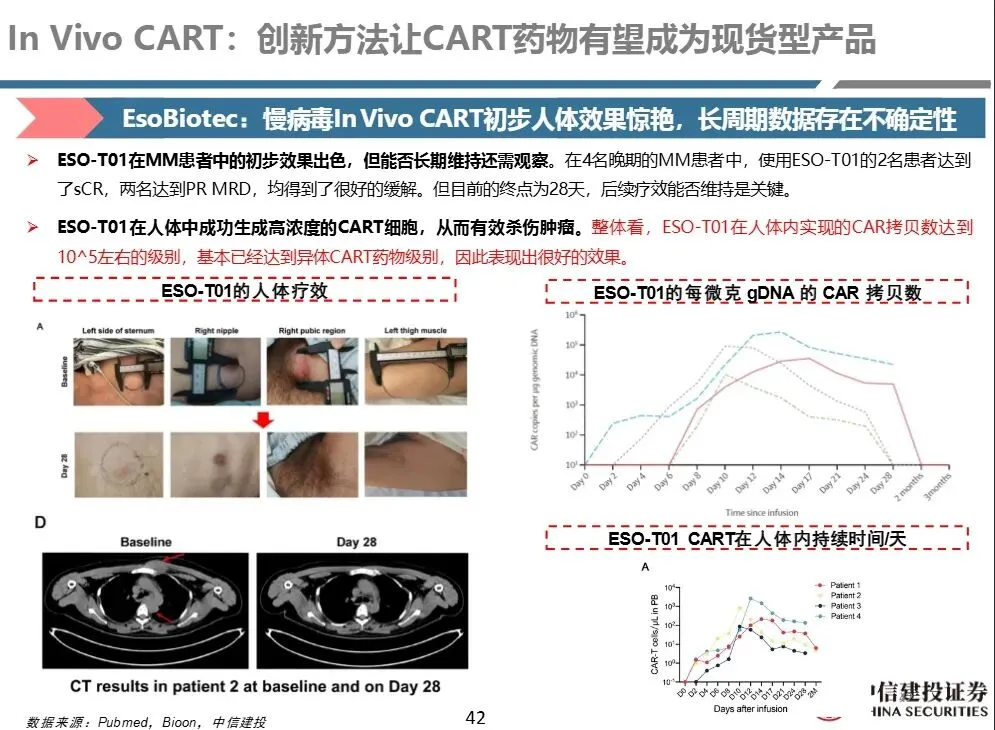
- 基因整合带来长期表达,CAR-T存续时间长(ESO-T01(慢病毒)在小鼠中达峰约10天,40天仍可检测)
- 免疫原性高,有插入突变风险
- 杀伤能力强,更适合肿瘤治疗
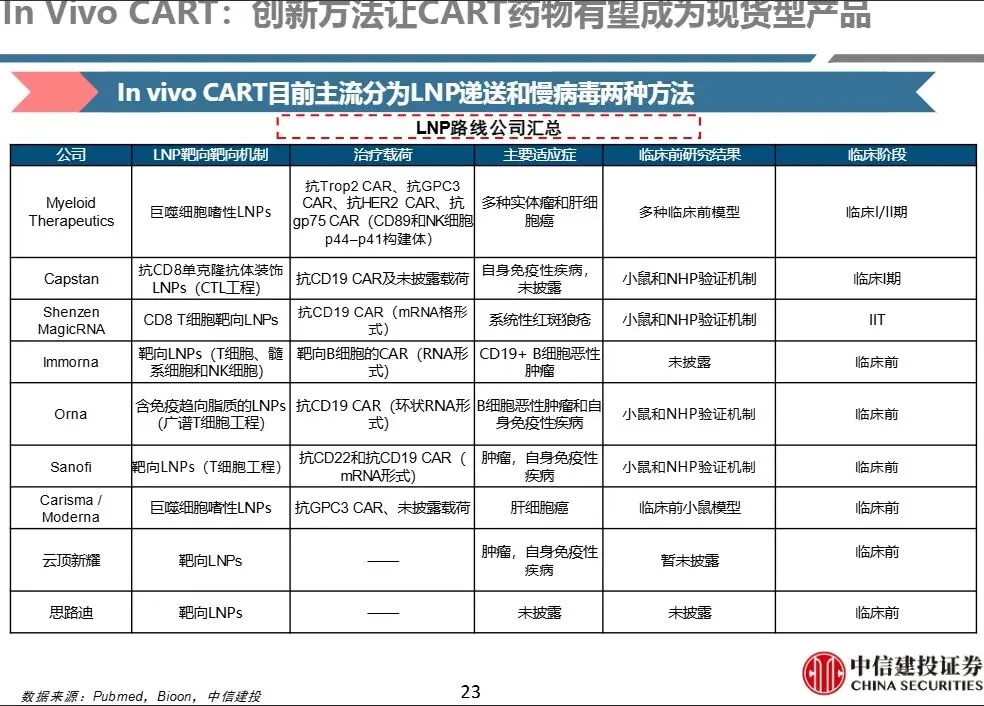
- 2、LNP(靶向核酸脂质纳米颗粒)路线
- 核心物质:mRNA(翻译后直接生效)
- 不整合基因,安全性较高,免疫原性低
- CAR-T存在时间短,杀伤力中等(LNP路线(如Capstan)仅10小时达峰,衰减快)
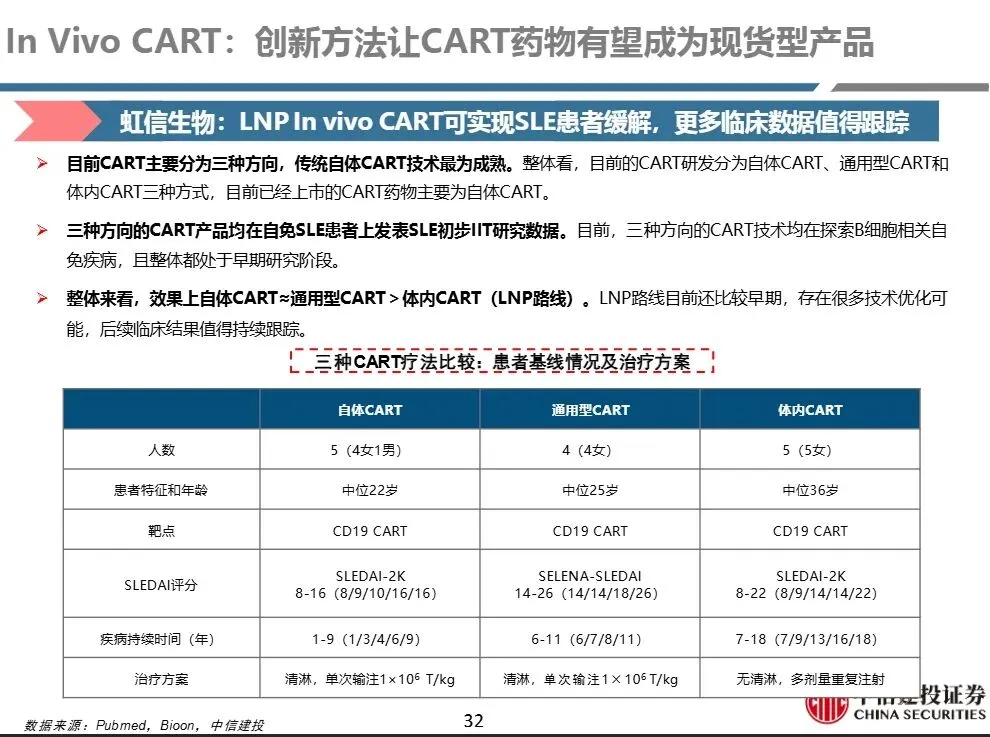
- 更适合B细胞相关自身免疫病(如SLE)
整体回顾
- 目前主要困难:LNP路线疗效不如自体CAR-T,慢病毒路线长期安全性未知。
- 但技术优化空间大:如LNP靶向效率、mRNA稳定性、慢病毒插入突变控制等。
赛道处于早期高速发展阶段,技术空间大,多家国内企业布局但达到I期的似乎只有三家。 - 空间广阔,重点关注后续人体数据进展和技术迭代。