部分研报原稿放在文末
【药企研发关注】
- 未满足临床需求与细分市场:
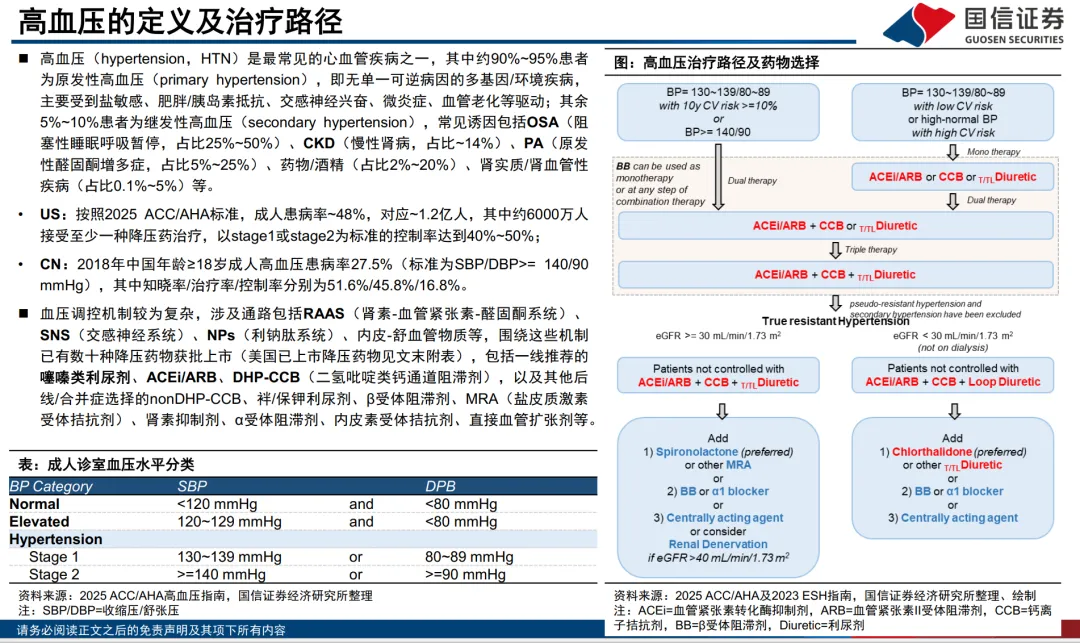
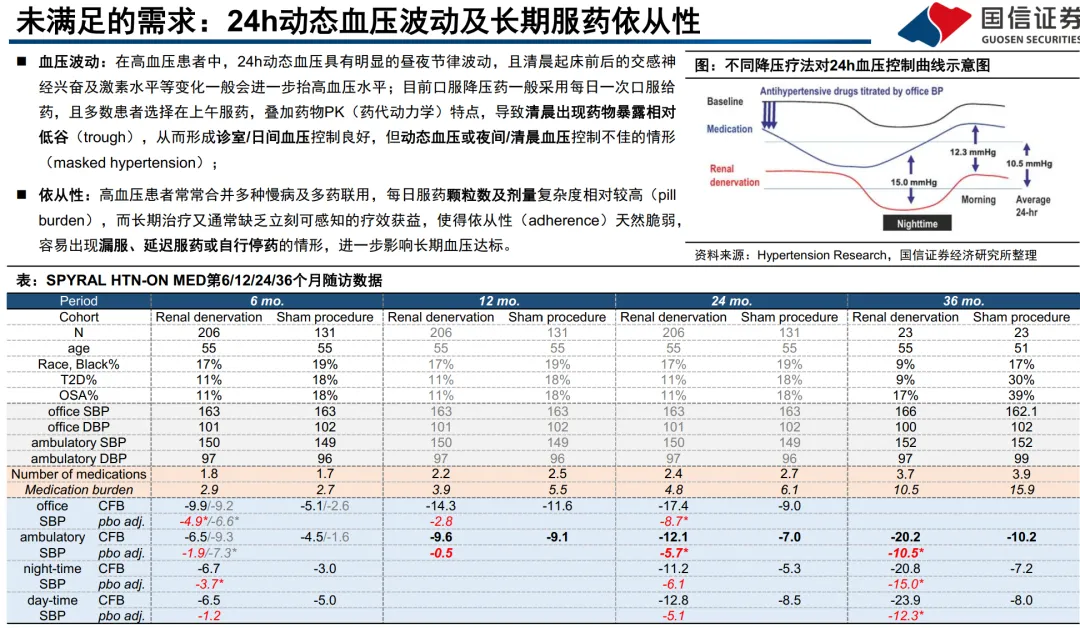
全球约13亿成人患高血压,但控制率仅20%(WHO报告)。难治高血压(rHTN,使用≥3种药物仍未控制)患者规模显著,例如美国rHTN人群约690-890万。PATHWAY-2试验证实,即使使用三药方案(ACEi/ARB+CCB+利尿剂),仍有大量患者血压不达标,凸显后线药物开发紧迫性。 - 下一代核心创新路径:ASI与AGT siRNA:
- 醛固酮合成酶抑制剂(ASI)
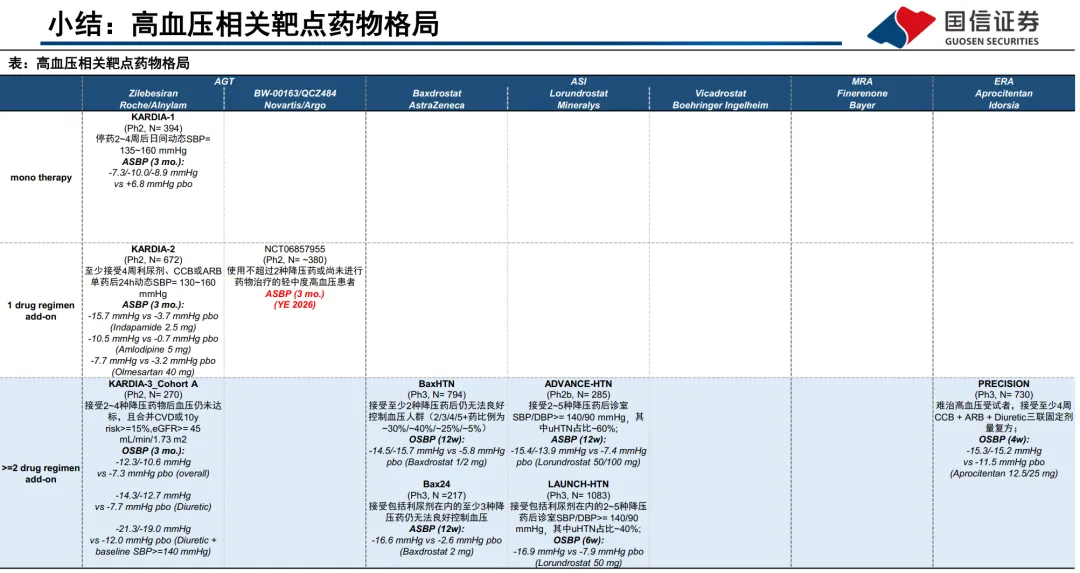
:代表药物如Baxdrostat(阿斯利康)。它通过高选择性抑制醛固酮合成酶(CYP11B2)从源头减少醛固酮生成,理论上避免了MRA的性激素副作用。Baxdrostat在关键的BaxHTN III期研究中显示,在三药基础上能使诊室收缩压额外降低8.7-9.8 mmHg,动态血压额外降低14.6-16.9 mmHg,效果与螺内酯相当甚至更优,且高选择性(对CYP11B2:B1选择性达100:1)确保了对皮质醇轴影响极小。 - 血管紧张素原(AGT)siRNA
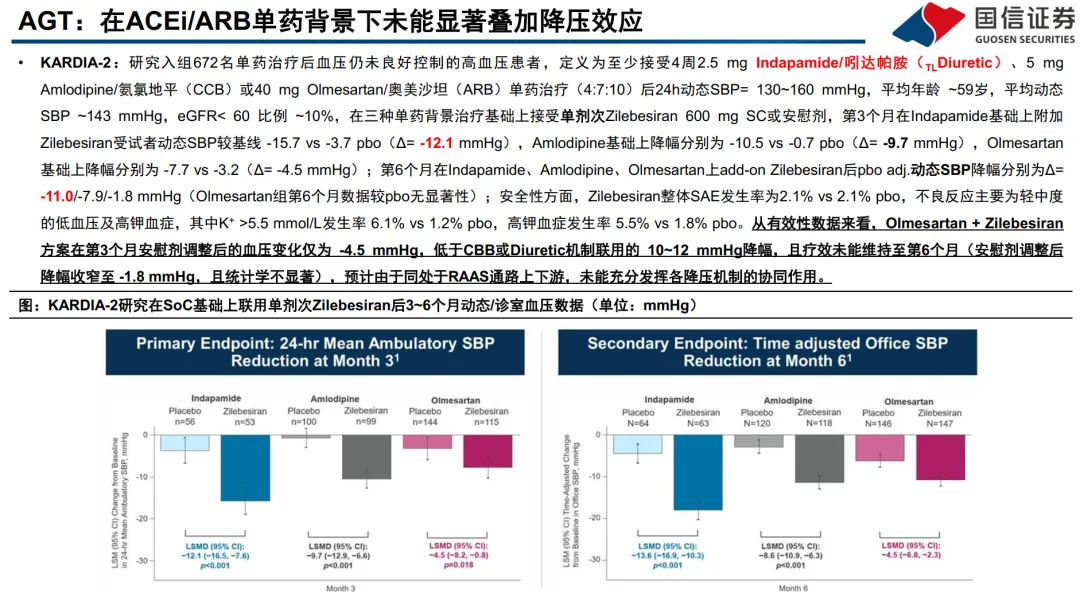
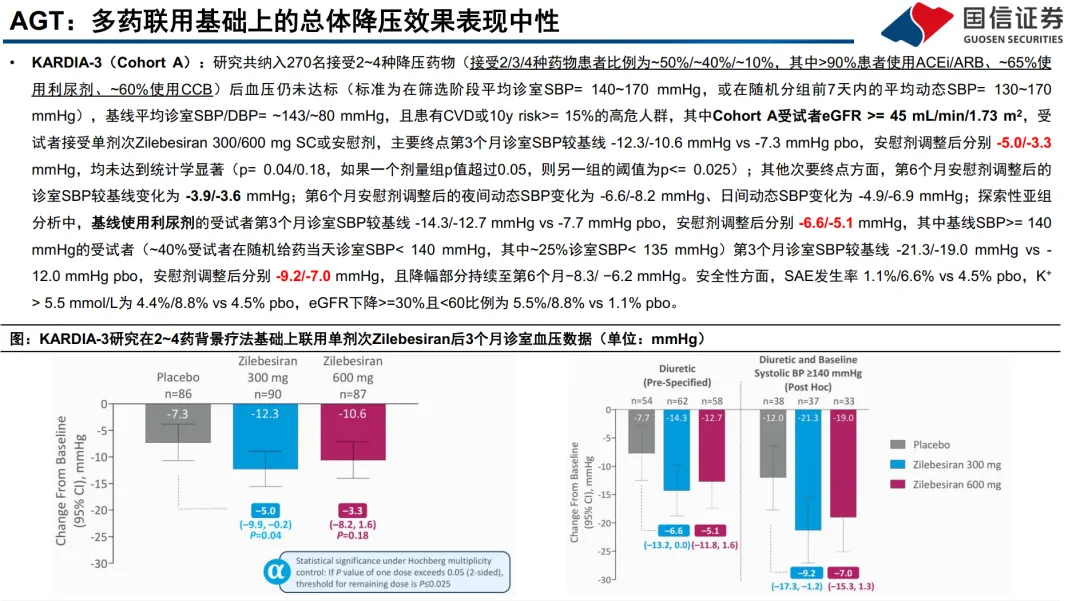
:代表药物Zilebesiran(罗氏/Alnylam)。通过靶向RAAS通路最上游的AGT mRNA,长效抑制蛋白合成,实现半年一次皮下给药。其优势在于卓越的依从性,单药降压效果显著(KARDIA-1研究24小时动态血压降低14-17 mmHg)。但关键挑战在于与现有RAAS抑制剂(如ARB)联用时,降压效果可能不叠加(KARDIA-2研究中,在奥美沙坦背景上加用,6个月时效果不显著),提示其更适合用于非RAAS背景或多药治疗患者。 - 临床开发与试验设计的启示:
- Zilebesiran在*基线使用利尿剂、且收缩压较高(≥140 mmHg)*的亚组中疗效更突出。
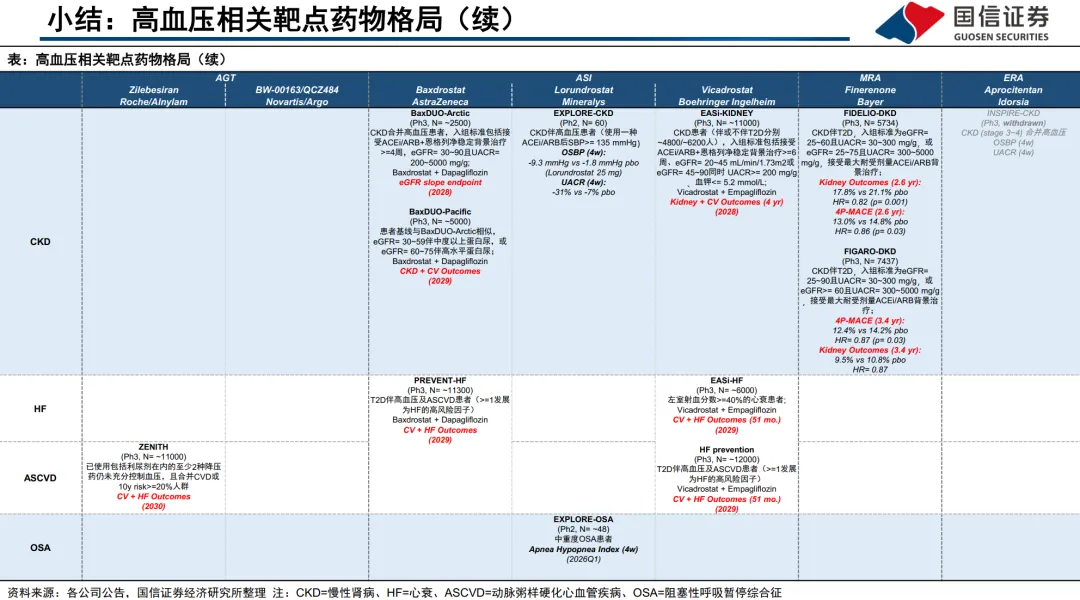
- 未来的竞争已从单纯的“降压幅度”扩展到对心、肾硬终点的获益验证。例如,Baxdrostat正开展与SGLT2i联合的心肾结局试验;Zilebesiran也启动了针对ASCVD高危人群的CVOT研究ZENITH。
- 组合与联用策略的理性思考:
报告明确警示,相同通路上下游的药物联用可能无法产生协同效应(如Zilebesiran与ARB)。未来的联合策略更应关注跨机制互补,如ASI与SGLT2抑制剂的联用(EASi-KIDNEY、BaxDUO等研究),或新型药物与RDN(肾动脉交感神经消融术)等器械疗法的序贯使用。
【投资者关注】
- 一个存在结构性机会的细分赛道:
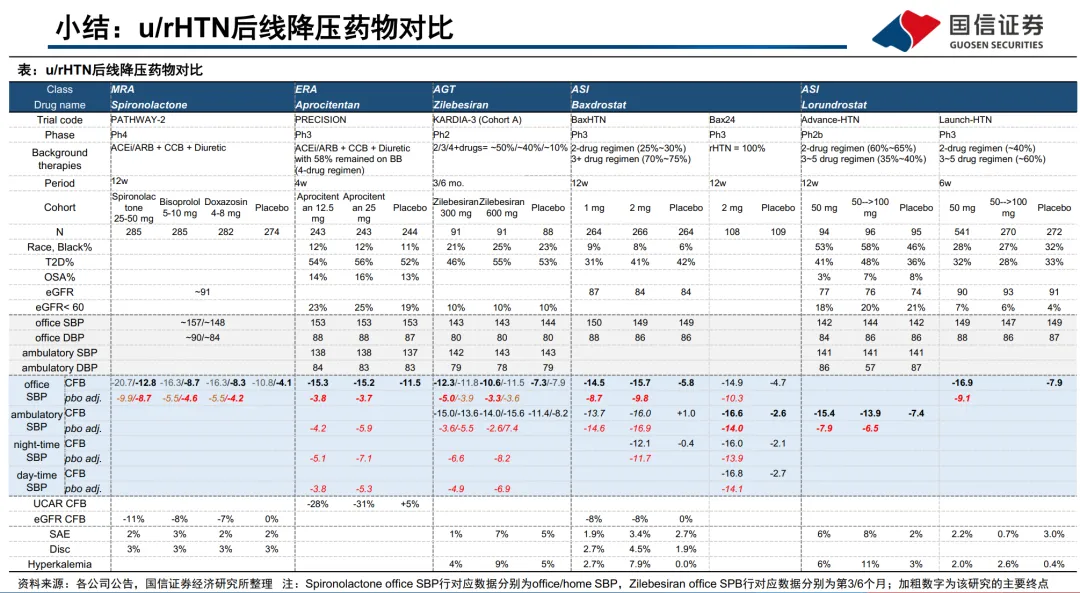
“难治高血压”患者在美国(以≥140/90mmHg标准)规模约690万-890万,且多数合并CKD、糖尿病或心血管疾病,治疗需求刚性。现有主流4线药物螺内酯因副作用问题,真实世界渗透率仅9-10%,为新机制药物留下了明确的替代和市场扩张空间。 - 管线进展与数据对比是估值核心锚点:
目前下一代药物中,ASI抑制剂Baxdrostat临床进展最快,已基于两项阳性III期研究(BaxHTN, Bax24)向FDA提交NDA并获得优先审评,预计2026年Q2出结果,是近期最明确的催化剂。其降压数据扎实,安全性担忧低于传统MRA。 - 投资风险点具体化:
- 临床失败风险
:Zilebesiran在KARDIA-3(2-4药背景)整体人群数据“中性”,提示其临床开发路径可能比预想更曲折。 - 商业化和支付风险
:参照PCSK9抑制剂上市初期的经历(约70%处方曾遭拒赔),新降压药可能面临严格的医保控费审查,导致放量速度慢于预期。 - 竞争格局与迭代风险
:除Baxdrostat、Zilebesiran外,Mineralys的Lorundrostat(ASI)和BI的Vicadrostat(ASI)也处于后期阶段,且国内多家企业(如舶望/诺华、恒瑞、信达等)的AGT siRNA管线也已进入临床,未来竞争可能加剧。 - 技术路径的优劣与投资选择:
短期看,口服ASI(小分子)路径因开发模式成熟、患者接受度高、临床数据领先,确定性更强。长期看,长效siRNA路径若能克服与现有疗法联用的瓶颈,并在CVOT中证明能减少心肾事件,其“超长效”带来的依从性优势将可能颠覆现有口服药市场格局,想象空间更大,但风险也更高。
【高校科研关注】
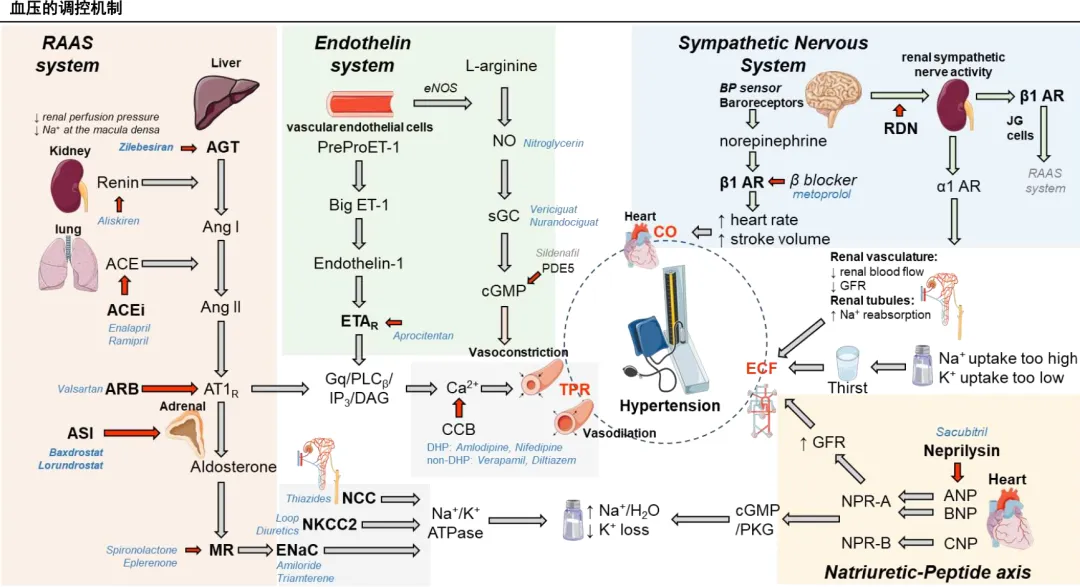
- 复杂调控网络是创新源头:
血压调控涉及RAAS系统、交感神经系统、利钠肽系统、内皮素系统等多个通路的复杂交互。现有药物多作用于下游(如受体拮抗),而针对最上游靶点(如肝源AGT)或关键合成酶(如肾上腺CYP11B2)的干预,为从源头更稳定地调控血压提供了新的生物学基础和研究方向。 - 新靶点的转化医学案例:
对醛固酮合成酶(CYP11B2)抑制剂的研究历经数十年,早期药物(如Osilodrostat)因对同源的皮质醇合成酶(CYP11B1)选择性不足(8:1)而失败。新一代高选择性ASI(如Baxdrostat选择性达100:1, Lorundrostat达374:1)的成功,是基于结构的药物设计(SBDD)和精准靶向的完美体现。 - 颠覆性给药技术的应用:AGT siRNA(如Zilebesiran)
采用GalNAc偶联技术实现肝靶向递送,将高血压治疗从每日口服转变为半年一次皮下注射,极大解决了慢性病长期依从性的根本痛点。这不仅是靶点的创新,更是核酸药物技术和长效制剂技术在心脑血管慢病领域的重大突破和验证。 - 多学科交叉的前沿合作:
- 生物信息学与患者分型:如何利用基因组、蛋白质组等多组学数据,在RAAS系统内精准识别对ASI敏感、或对AGT siRNA应答更佳的高血压亚型患者,是实现“精准高血压治疗”的关键科学问题。
- 药物联用与系统生物学:为何AGT siRNA与下游ARB联用效果受限?这涉及到RAAS通路被深度抑制后的代偿与反馈机制,以及不同组织(如肝、肾、血管)中RAAS的差异,需要系统药理学和定量系统 pharmacology 模型来解答和预测最佳联用方案。
- 科研的社会价值:
WHO报告指出,全球高血压控制率低(如中国仅16.8%)的核心是系统性问题。高校科研不应仅聚焦于“高精尖”新药,也应致力于解决“最后一公里”问题,例如:开发低成本、易用的家庭血压监测设备;研究如何通过行为干预、数字疗法(mHealth) 提升患者依从性;或探索适用于基层卫生机构的简化、高效的降压治疗方案(如固定剂量复方)。这些“低技术”创新同样具有巨大的公共卫生价值和转化潜力。







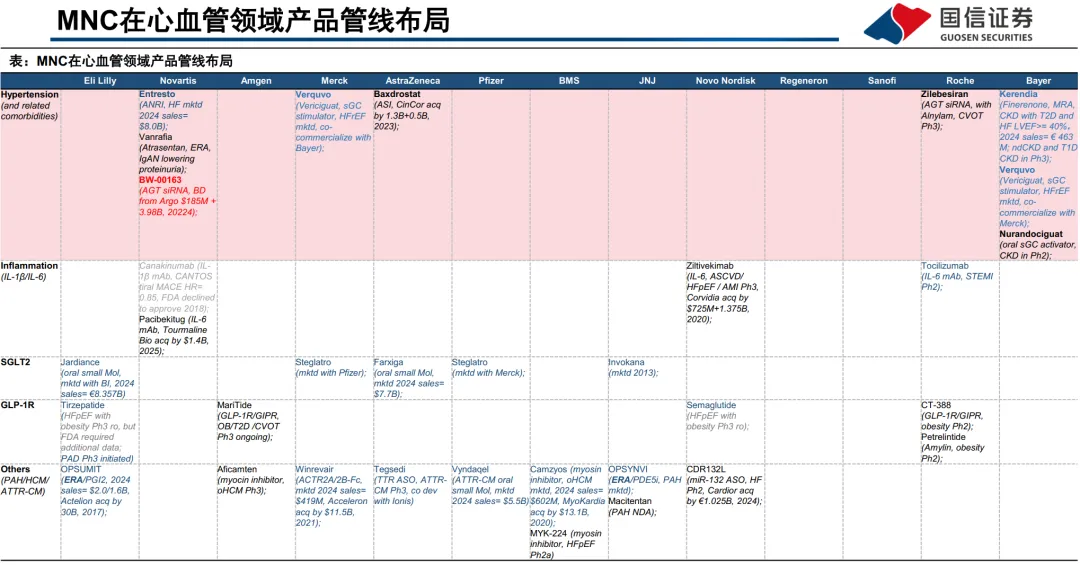
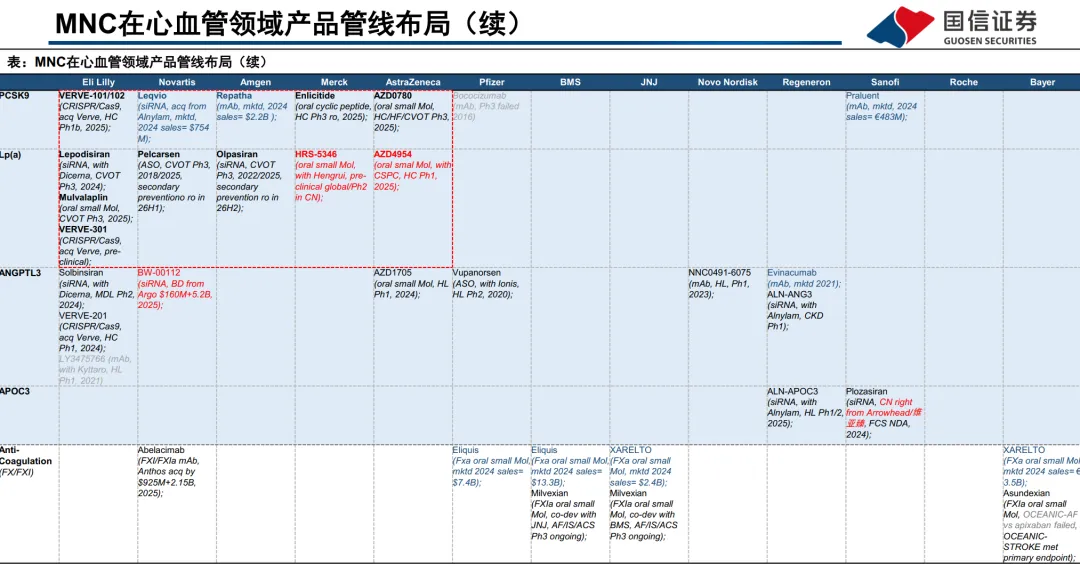
2025全球高血压报告
2025-创新药盘点系列报告(24)_难治高血压后线药物梳理

